Grupos o familias
No es coincidencia que muchos de estos grupos correspondan a
conocidas familias de elementos químicos, ya que la tabla
periódica se ideó para ordenar estas familias de una forma coherente y fácil de
ver. La explicación moderna del ordenamiento en la tabla periódica es que los elementos de un
grupo tienen configuraciones electrónicas similares en los niveles de energía más
exteriores; y como la mayoría de las propiedades químicas dependen
profundamente de las interacciones de los electrones que están colocados en los
niveles más externos los elementos de un mismo grupo tienen propiedades físicas
y especialmente químicas parecidas.
Numeración de los grupos
Actualmente la forma en la que se suelen numerar los 18 grupos
es empleando el sistema recomendado por la IUPAC (International Union of Pure and Applied
Chemistry) en 1985, que consiste en utilizar números arábigos. De esta forma la
primera columna es el grupo 1, la segunda el grupo 2, y así hasta la
decimoctava que corresponde al grupo 18.
Anteriormente a la forma de la IUPAC existían dos maneras de
nombrar los grupos empleando números romanos y letras, un sistema europeo y
otro estadounidense, ambos cada vez más en desuso. En el sistema europeo
primero se pone el número romano y luego una A si el elemento está a la
izquierda o una B si lo está a la derecha. En el estadounidense se hace lo
mismo pero la A se pone cuando se trata de elementos representativos (grupos 1,
2 y 13 a 18) y una B para los elementos de transición. En ambos casos, los
grupos se numeran del I al VIII, comprendiendo el grupo octavo de los elementos
de transición tres columnas de la tabla periódica que se denominan tríadas.
|
IUPAC
|
Europa
|
EE. UU.
|
Nombre
|
|
|
IA
|
IA
|
|
|
|
IIA
|
IIA
|
|
|
|
IIIA
|
IIIB
|
Metales de transición
|
|
|
IVA
|
IVB
|
|
|
VA
|
VB
|
|
|
VIA
|
VIB
|
|
|
VIIA
|
VIIB
|
|
|
VIIIA
|
VIIIB
|
|
|
|
|
|
|
IB
|
IB
|
|
|
IIB
|
IIB
|
|
|
IIIB
|
IIIA
|
Térreos
|
|
|
IVB
|
IVA
|
Carbonoides
|
|
|
VB
|
VA
|
Nitrogenoides
|
|
|
VIB
|
VIA
|
|
|
|
VIIB
|
VIIA
|
|
|
|
VIIIB
|
VIIIA
|
|
|
Las denominaciones de los grupos 13 a 16
están en desuso
|
A las columnas verticales de la tabla
periódica se les conoce como grupos. Todos los elementos que pertenecen a un
grupo tienen la misma valencia atómica,
y por ello, tienen características o propiedades similares entre sí. Por
ejemplo, los elementos en el grupo IA tienen valencia de 1 (un electrón en su
último nivel de energía)
y todos tienden a perder ese electrón al enlazarse como iones positivos de +1. Los elementos en el último
grupo de la derecha son los gases nobles, los cuales tienen lleno su último
nivel de energía (regla del octeto) y, por ello, son todos extremadamente no
reactivos.
Numerados de izquierda a derecha
utilizando números arábigos, según la última recomendación de la IUPAC (según la antigua propuesta de la IUPAC) de 1988[2] , los grupos de la tabla
periódica son:
Grupo 4 (IV B): Familia del Titanio
Grupo 6 (VI B): Familia del Cromo
Grupo 8 (VIII B): Familia del Hierro
Grupo 9 (VIII B): Familia del Cobalto
Grupo 10 (VIII B): Familia del Níquel
Grupo 11 (I B): Familia del Cobre
Grupo 12 (II B): Familia del Zinc
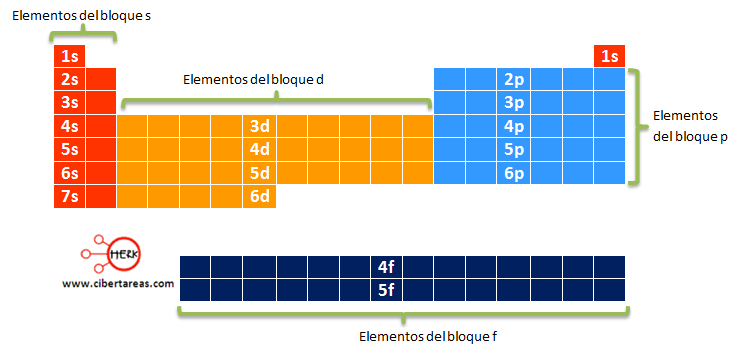
BLOQUES S, P ,D,F
Tabla periódica dividida en bloques.
La tabla periódica se puede también dividir en
bloques de elementos según el orbital que estén ocupando los electrones más
externos.
Los bloques o regiones se denominan según la letra
que hace referencia al orbital más externo: s, p, d y f.
Podría haber más elementos que llenarían otros orbitales, pero no se han
sintetizado o descubierto; en este caso se continúa con el orden alfabético
para nombrarlos.
Actualmente la tabla periódica se organiza en grupos y periodos, y se subdivide en cuatro bloques, s, p, d, y f, dependiendo del último orbital de la configuración electrónica.
Para entender de mejor manera como se logra ubicar los elementos en un blique determinado, vamos a analizar el siguiente ejemplo:
Grupo IA (1)
Metales alcalinos: Li, Na, K, Rb, Cs, Fr
Veamos la configuración electrónica para cada uno de ellos:
Como se observa, estos elementos presentan una configuración electrónica similar en su último nivel, ya que todos y cada uno tienen su electrón más externo en un orbital s, y esta es la razón por la cual se ubican en el grupo IA.
Es preciso recordar que el nivel energético equivale numéricamente al periodo en el cual se ubica dentro de la tabla.
Ahora vamos a analizar el aluminio
Numero atómico 13
Configuración electrónica:
Observemos que el aluminio tiene un total de tres electrones, estos están ubicados en la última capa (3s23p1), a partir de estos datos se puede afirmar que el aluminio se ubica en el periodo tres, ya que los electrones están en el tercer nivel de energía, se ubica en el grupo III, esto es porque tiene 3 electrones en su última capa y pertenece a un grupo tipo A porque los electrones de la última capa se ubica en orbitales s y p. El aluminio está en el grupo IIIA, periodo tres y bloque tres, para poder ubicarlo en el bloque determinado solo se necesita saber en qué tipo de orbital queda situado el electrón diferencial.
Si se conoce la configuración electrónica de un elemento, se puede determinar el grupo, el periodo y el bloque en los que se ubica en la tabla periódica.
METALES ,SEMIMETALES Y NO METALES
METALES Y NO METALES
La clasificación más fundamental de los
elementos químicos es en metales y no metales. Los metales se caracterizan por
su apariencia brillante, capacidad para cambiar de forma sin romperse (
maleables ) y una excelente conductividad del calor y la electricidad.
Los no
metales se caracterizan por carecer de estas propiedades físicas aunque hay
algunas excepciones (por ejemplo, el iodo sólido es brillante; el grafito, es
un excelente conductor de la electricidad; y el diamante, es un excelente
conductor del calor). Las características químicas son : los metales tienden a
perder electrones para formar iones positivos y los no metales tienden a ganar
electrones para formar iones negativos. Cuando un metal reacciona con un no
metal, suele producirse transferencia de uno o mas electrones del primero al
segundo.
La
mayoría de los elementos se clasifican como metales. Los metales se encuentran
del lado izquierdo y al centro de la tabla periódica. Los no metales, que son
relativamente pocos, se encuentran el extremo superior derecho de dicha tabla.
Algunos elementos tienen comportamiento metálico y no metálico y se clasifican
como metaloides y semi metales.
Los no
metales también tienen propiedades variables, al igual que los metales. En
general los elementos que atraen electrones de los metales con mayor eficacia
se encuentran en el extremo superior derecho de la tabla periódica.
METALES ALCALINOS
Los
metales alcalinos son aquellos que se encuentran en el primer grupo dentro de
la tabla periódica .
Los
compuestos de los metales alcalinos son isomorfos, lo mismo que los compuestos
salinos del amonio. Este radical presenta grandes analogías con los metales de
este grupo.
Estos
metales, cuyos átomos poseen un solo electrón en la capa externa, son
monovalentes. Dada su estructura atómica, ceden fácilmente el electrón de
valencia y pasan al estado ionico. Esto explica el carácter electropositivo que
poseen, así como otras propiedades.
METALES ALCALINOTERREOS
Se
conocen con el nombre de metales alcalinotérreos los seis elementos que forman
el grupo IIA del sistema periódico: berilio , magnesio , calcio , estroncio ,
bario y radio. Son bivalentes y se les llama alcalinoterreos a causa del
aspecto térreo de sus óxidos. Como el nombre indica, manifiestan propiedades
intermedias entre los metales alcalinos y los térreos; el magnesio y, sobre
todo, el berilio son los que mas se asemejan a estos. No existen en estado
natural, por ser demasiado activos y, generalmente, se presentan formando
silicatos, carbonatos, cloruros y sulfatos. Los metales son difíciles de
obtener, por lo que su empleo es muy restringido.
HALÓGENOS
El
flúor, el cloro, el bromo, el yodo y el astato, llamados metaloides halógenos,
constituyen el grupo de los no metales monovalentes. Todos ellos son coloreados
en estado gaseoso y, desde el punto de vista químico, presentan propiedades
electronegativas muy acusadas, de donde se deriva la gran afinidad que tienen
con el hidrógeno y los metales.
GASES NOBLES O GASES RAROS
Los
gases nobles, llamados también raros o inertes, entran, en escasa proporción,
en la composición del aire atmosférico. Pertenecen a este grupo el helio , neón
, argón , criptón , xenón y radón , que se caracterizan por su inactividad
química , puesto que tienen completos sus electrones en la ultima capa .
METALES DE TRANSICIÓN
Esta es
una familia formada por los grupos IIIB, IVB, VB, VIB, VIIB, IB y IIB, entre
los que se encuentran los elementos cobre, fierro, zinc, oro, plata, níquel y
platino.
Las
características de los metales de transición son muy variadas, algunos se
encuentran en la naturaleza en forma de compuestos; otros se encuentran libres
DESCRIPCIÓN DE LA IMPORTANCIA DE LOS METALES Y NO METALES ASÍ COMO SUS CARACTERÍSTICAS
Acidez.- Se caracterizan por su acidez, pues la gran mayoría de los óxidos de los no metales forman algunas soluciones ácidas.
Brillantez.- Por su naturaleza los no metales tienen poca brillantez a diferencia de los metales.
Calor.- La transmisión de calor es más reducida en los no metales.
 Conductividad.- Los no metales no son buenos conductores Los no metales se distinguen principalmente por no ser buenos conductores, aunque esto no quiere decir que no puedan conducir.
Conductividad.- Los no metales no son buenos conductores Los no metales se distinguen principalmente por no ser buenos conductores, aunque esto no quiere decir que no puedan conducir.
Ductilidad.- Los no metales no tienen la capacidad de doblarse o estirarse, por lo que no se pueden hacer láminas mediante deformaciones plásticas.
Gases.- Estos elementos en su gran mayoría son gases.
Propiedades químicas.- Entre las propiedades químicas de los no metales es que en su última capa tienen desde 4 hasta 7 electrones y al ionizarse pueden adquirir carga negativa y con el oxígeno forman oxidaciones no metálicas o anhídridos.
Semiconducción.- Estos elementos por su reducida o nula conducción son utilizados como aislantes o como semiconductores dentro de los aparatos y dispositivos.
Qué son los metales?
A los elementos químicos que se identifican por encontrarse en estado sólido ante temperaturas medias, por ser altamente densos y por ser conductores de la energía eléctrica y el calor se los conoce bajo el nombre de metales.
Además, estos elementos químicos tienen cualidades propias, entre ellas, se los identifica por ser maleables, sólidos, dúctiles, brillantes, resistentes y tenaces, entre otras cosas.
Clasificación de los metales
Los metales pueden ser clasificados de la siguiente manera:
-Ferrosos: estos metales se caracterizan por contener óxido de hierro como mineral de origen. Este elemento químico se caracteriza por su capacidad de ser tanto repelido como atraído por las fuerzas magnéticas. A este fenómeno se lo conoce bajo el nombre de ferromagnetismo.
Por lo general, el hierro no es hallado en su estado metálico, sino junto a minerales tales como la limonita o la magnetita. Además, otros rasgos propios de los metales ferrosos son que pueden ser reciclados, poseen una resistencia significativa, son maleables, tienen una elevada conductividad para el calor y la electricidad y, por último, se los identifica por su plasticidad.
Los metales ferrosos se dividen en dos grupos:
1. Acero: este metal se caracteriza por estar compuesto por carbono, en un porcentaje menor a los 2,11 por ciento, y hierro. A este compuesto se le agregan elementos de aleación de diferentes clases, que le otorgan aquellas cualidades mecánicas que se precisen a nivel industrial. Dentro de estos metales se identifican, entre otros, el fósforo, el cobre, el cobalto, el níquel, el cromo y el vanadio. El acero puede ser fabricado a través de diferentes procesos. Algunos de ellos son el estampado y punzado, en el que se presiona al metal utilizando prensas, moldes y troqueles, para así conferirle la forma que se desee. El laminado es otro proceso utilizado para la confección de acero. Consiste en colocar en una fila de rodillos un trozo de acero para que se aplane y moldee de acuerdo a la forma que se precise. Por último, otro de los procesos utilizados es la extrusión, que es cuando se coloca al acero en un cubo que, por medio de presiones elevadas, deforman el acero para luego darle la forma que se quiera.
2. Fundiciones: estos metales consisten en aleaciones realizadas, en principio, con carbono y hierro, a las que se le pueden agregar otros elementos. Con respecto a los porcentajes de carbono, estos se ubican entre el 1,70 y el 6,60 por ciento. Entre otras cosas, las fundiciones se caracterizan por no poder ser sometidas a procesos como la laminación ya que se trata de un material elevadamente fusibles. De acuerdo al tipo de fundición, se identifican distintos elementos químicos: ordinarias, aleada y especial.
Tipos de fundiciones
· La fundición ordinaria es aquella que está compuesta, únicamente, por carbono y hierro. Dentro de esta se pueden identificar tres clases de fundiciones: Blanca, gris y La fundición blanca sólo se utiliza para la fabricación de aleaciones maleables por tratarse de un elemento sumamente frágil y duro. La fundición gris se llama así ya que justamente el color del material químico adquiere este color por tener forma de grafito. Por último, la fundición atruchada es aquella que tiene cualidades tanto de la gris como de la blanca.
· La fundición aleada es aquella que contiene otros elementos químicos, además del carbono y el hierro, lo que hace que el material adquiera otras cualidades. De todas formas, las proporciones de hierro y carbono continúan siendo elevadas.
· Por último, la fundición especial es aquella que además de valerse de los procedimientos de fundición ordinaria se les otorga tratamientos térmicos específicos. En este tipo de fundiciones se identifican cuatro variantes: maleable de corazón negro, maleable de corazón blanco, maleable de grafito modular y maleable paralítica. La de corazón blanco se caracteriza por el hecho que el moldeo se realiza en fundición blanca, en la que el material es sometido a temperaturas de 1.000° C por más de una semana. Luego de esto, el material debe enfriarse, lo que lleva unos cinco días. La de corazón negro también se realiza en fundición blanca pero a una temperatura de unos 900° C y durante algo menos que una semana, para que luego se enfríe. La perlítica también se hace en fundición blanca a una temperatura similar a la anterior, pero el material debe ser recubierto con arena. Por último, la de grafito modular se identifica porque al hierro y carbono se le agrega magnesio y cerio, que debe ser sometido a elevadas temperaturas.

Los metales:
 En la vida cotidiana tenemos una gran cantidad de Herramientas, Tecnologías y Utensilios que utilizan en mayor o menor medida a los Metales como parte de su conformación, como sostén a las distintas estructuras, como también para poder brindar una utilidad a su funcionamiento, siendo muy importante su extracción y utilización, mucho más de lo que pensamos.
En la vida cotidiana tenemos una gran cantidad de Herramientas, Tecnologías y Utensilios que utilizan en mayor o menor medida a los Metales como parte de su conformación, como sostén a las distintas estructuras, como también para poder brindar una utilidad a su funcionamiento, siendo muy importante su extracción y utilización, mucho más de lo que pensamos.
Los metales son extraídos de entre las rocas mediante distintas técnicas, difícilmente encontrados en Estado Puro, el que es conocido también como Metal Elemental, por lo que su aplicación en la industria está basado en la utilización de combinaciones que son conocidas como Aleaciones Metálicas, que permiten su aplicación en distintas formas y diseños.
Una de las principales aplicaciones del metal está ligada a su Conductividad Eléctrica, por lo que todos los artículos de Electrónica e Informática cuentan en su conformación con distintos tipos de metales en su Circuito Eléctrico, formando parte de los distintos Cables de Alimentación o inclusive para la transmisión de datos.
En la vida cotidiana y en forma histórica se utiliza a los metales como Utensilios, lo que permite un mejor manejo de los alimentos a la hora de preparar las distintas recetas, como también en Cortar y Trozar los mismos, además de emplearse los metales, por su gran Conductividad Térmica, como distintos elementos de cocina que permiten calentar, hornear y preparar distintos alimentos.
Es un material que cuenta con la capacidad de ser muy Maleable y Dúctil, teniendo por un lado la facilidad para poder adoptar cualquier forma (desde lingotes hasta hilos o laminillas) como también la posibilidad de brindar una altísima resistencia, sumado a que su Estructura Cristalográfica le permite recuperar su posición original sin ofrecer demasiadas modificaciones en el punto que ha sido sometida a distintos Procesos Fisicoquímicos.
Los no metales son elementos químicos que se definen por ser diametralmente opuestos a los metales, estos elementos pierden las cualidades que caracterizan a los metales y podemos mencionar los siguientes:
Argón, Astato, Azufre, Bromo, Carbono, Cloro, Criptón, Flúor, Fosforo, Helio, Hidrogeno, Neón, Nitrógeno, Oxigeno, Radón, Selenio, Xenón, Yodo.
Los no metales pueden ser desde gases hasta cloruros.
COMENTARIO: las clasificaciones de los elementos es muy importante ya que cada grupo,familia y periodo son de una forma muy especificada y con caracteristicas muy importantes
AUTORA: ANDREA BEATRIZ CANCHE CHAN 1"B"